Хелатная форма магния, что это значит?
Содержание:
- Возможные опасности хелатотерапии
- Хелатные комплексы
- Дигидрат диоксалатокупрат (ΙΙ) калия
- Это важно
- Биологические функции
- Инструкция по применению
- Самостоятельное приготовление хелата железа
- ТОП лучших препаратов железа при низком гемоглобине
- Когда необходимы?
- Можно ли микроэлементы заменить другими веществами?
- Лучшие хелатные препараты
- Споры разгораются
- Применения хелата железа для растений
- Проблема недостатка питательных элементов
- Примечания и ссылки
Возможные опасности хелатотерапии
Противники хелатотерапии ссылаются на ранние исследования ЭДТА, применяемой для лечения поражений почек. Не так давно они высказали предположение, что она может способствовать развитию остеопороза (разрежение костей) и даже вызывать опасные для жизни осложнения.
Врачи-практики признают, что на начальных этапах развития хелатотерапии не была определена допустимая для лечения доза, и некоторым пациентам вводили слишком большое количество ЭДТА в течение короткого времени. Большинство медиков и учёных в США все ещё скептически относятся к лечению сердечных больных этилендиаминтетрауксусной кислотой. Они советуют пациентам до получения научно обоснованных данных об эффективности ЭДТА в лечении поражений артерий использовать уже проверенные старые методы: обезжиренное питание, физические упражнения, жизненный образ жизни, в некоторых случаях операция искусственного кровообращения.
Хелатные комплексы
Бурятский государственный университет
Химический факультет
КУРСОВАЯ РАБОТА
Тема: Хелатные комплексы
Улан-Удэ
год.
Введение
Комплексные соединения представляют собой интересный класс веществ в
неорганической химии. Их природа представляет для науки большой интерес, так
как значительное количество элементов периодической системы могут образовывать
комплексы, как с другими элементами, нейтральными молекулами, так и с катионами
(анионами) кислотных (основных) остатков.
Особую группу составляют циклические комплексные соединения или хелаты.
Хелатную структуру имеют многие комплексы. Так, например молекула гемоглобина
представляет собой комплекс, который соединяет атом Fe(II) и
тетрадентатный хелатообразующий лиганд — порфирин. Этот лиганд образует
комплекс с магнием, который называется хлорофил.
Цель работы.
Основной целью данной работы является получение, изучение физических и
химических свойств хелатных комплексов. Интерес состоит в том, что хелаты по
отношению к другим комплексам обладают интересными свойствами: циклическое
строение, повышенная прочность. Еще одна причина по которой стоит изучать
хелатные комплексы — большинство органических комплексов в живой природе
относятся именно к ним. Так же в данной работе вообще затрагивается вообще вся
химия комплексных соединений и имена тех кто вложил большой вклад в изучение
комплексных соединений.
Задачи.
1) Подобрать теоретический материал.
2) Подобрать методики синтезов необходимых нам соединений.
) Повести синтез хелатных соединений
) Сделать выводы.
Глава первая.
Теоретическая часть
.1 Классификация комплексных соединений
Комплексные соединения (К.С.) — соединения образованные сложными
катионными и анионными составляющими единую структуру.
Применяется несколько видов классификаций комплексов:
По принадлежности к определенному классу соединений
Комплексные кислоты — H2[SiF6], H;
Комплексные основания — [Ag(NH3)2]OH, [Co(En)3](OH)3.
По природе лигандов
Если лигандом является вода, комплексы называются аквакомплексами,
например, [Co(H2O)6]SO4, [Cu(H2O)](NO3)2. Находящиеся в водном
растворе гидратированые катионы содержат в качестве центрального звена
аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов
удерживают и кристаллизационную воду, например: [Cu(H2O)4]SO4·H2O и др. Кристаллизационная вода не
входит во внутреннюю сферу, она связана менее прочно, чем координационная, и
легче отщепляется при нагревании.
Комплексы образованные аммиаком — аммиакаты, например[Ag(NH3)2]Cl, [Cu(NH3)4]SO4. Известны комплексы аналогичные
аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH3NH2 (метиламин), C2H5NH2 (этиламин), NH2CH2CH2NH2 (этилендиамин, условно обозначаемый En) и др. Такие комплексы называют
аминатами.
Оксалатные, карбонатные, цианидные, галогенидные, и другие комплексы
содержащие в качестве лигандов анионы различных кислот, называются
ацидокомплексами. Например, K4[Fe(CN)6] и
K2[HgI4] —
цианидный иодидный ацидокомплексами,.
Соединения с OH-группами в виде
лигандов называют гидрокомплексами, например: K3[Al(OH)6].
По знаку заряда комплекса различают
Катионные комплексы — [Co(NH3)6]Cl3
анионные комплексы — Li[AlH4], K2[Be(CO3)2]
нейтральные комплексы — [Pt(NH3)2Cl2],
[Co(NH3)3Cl3].
Нейтральные комплексы не имеют внешней сферы. Более сложными являются бикомплексы,
состоящие из комплексных катионов и анионов, например [Co(NH3)6][Fe(CN)6].
Особую группу составляют сверхкомплексные соединения. В них число
лигандов превышает координационную валентность. Примером может служить CuSO4·5H2O. У меди координационная валентность
равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая
молекула присоединяется к комплексу при помощи водородных связей.
.2 Циклические или хелатные (клешневидные) комплексные соединения
Они содержат би- или полидентатный лиганд, (лиганды, образующие с
центральным атомом, две связи, называются бидентатными; образующие три связи —
тридентатные и т.д.) который как бы захватывает центральный атом подобно
клешням рака:
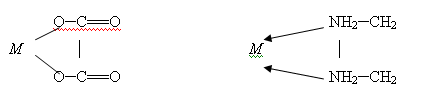
Дигидрат диоксалатокупрат (ΙΙ) калия
K2[Cu(C2O4)2]·2H2O
В термостойкий химический стакан ёмкостью 100 мл помещаем навеску
пентагидрата сульфата меди (ΙΙ) массой 5 г. и растворяем в 10 мл
воды (раствор Ι). Помещаем в другой химический стакан ёмкостью 100 мл
моногидрат оксалата калия массой 7,3 г и растворяем в 20 мл воды (раствор ΙΙ) и нагреваем оба раствора до 90оС.
Не охлаждая растворов, приливаем при интенсивном перемешивании раствор Ι к раствору II. После этого полученный раствор охлаждаем в водяной бане до
10С (внося в воду лёд).
Реакция синтеза

Рассчитываем количество вещества исходных компонентов, и по недостатку
определяем теоретический выход продуктов реакции:
Находим выход по CuSO4, т.к. он
находится в недостатке:
Полученный продукт просушил и взвесил, масса (K2[Cu(C2O4)2]) = 6,8 г.
Рассчитаем практический выход в % по отношению к теоретическому:
г — 100%
,8 г — Х%
Следовательно найдём выход
Проведем качественные реакции:
1) K2[Cu(C2O4)2] + 2NaOH(k) → Cu(OH)2↓
+ Na2C2O4 + K2C2O4 ( ион Cu2+)
Выпадает синий осадок гидроксида меди.
2) K2[Cu(C2O4)2]
+ Na3[Co(NO)2]→ K2Na[Co(NO2)6]
↓+ Na2C2O4 + (на ион K+)
Желтый осадок
Обесцвечивание раствора, выделение газа.
Снимаем спектр поглощения 0,01М раствора K2[Cu(C2O4)2]·2H2O(l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
|
D |
0,07 |
0,11 |
0,15 |
0,21 |
0,32 |
0,51 |
1,3 |
0,8 |

График№2
Спектра поглощения раствора K2[Cu(C2O4)2]
.3
Синтез №3
Получение
триоксалатоферрата(III) калия
K3[Fe(C2O4)3]
Цель:
получить хелатный комплекс калия и железа
Приборы и посуда:
1. Стаканы химические (V=100мл)
2. Весы
. Водяная баня
. Мерный цилиндр
. Фильтры бумажные
. Воронка Бюхнера, колба Бунзена
. Водоструйный насос
. Шпатель, стеклянная палочка
. Бюкс
Реактивы:
1. Дигидрат
хлорида бария BaCl2·2H2O
. Оксалат
натрия Na2C2O4
. Сульфат
железа (III)
. Этанол
. Вода
дистиллированная
Ход работы:
Вначале приготовим оксалат бария, для чего к раствору 1.5 г оксалата
натрия в 40 мл воды приливаем раствор 2,5г хлорида бария в 6мл воды. Происходит
выпадение кристаллов,


Теоретический выход 2,3
Практический
выход 1,2 или то есть 52%.
Далее
полученный оксалат бария, сульфат железа(1,25 г.) и оксалат калия(1,5 г.)
помещаем в стакан и добавляем 30мл. воды. Полученный раствор нагреваем на
водяной бане в течении 2-х часов поддерживая постоянный объем. Происходит
реакция:

Раствор
фильтруем и упариваем до объема 5мл и охлаждаем при комнатной температуре.
Происходит выпадение зеленоватых кристаллов. Отсасываем их на воронке Бюхнера и
немедленно помещаем в темное место для сушки.
Взвешиваем
получившиеся кристаллы, их масса равна 1,4г.
n(BaC2O4)=моль
n(3К2C2O4)моль
n(Fe2
(SO4)3 ) моль
Находим
теоретический выход по оксалату калия так как он в недостатке.
,5
→ х
498 → 874
Практический
выход равен 1,4 или 53%.
Проведем
качественные реакции:
)
K3[Fe(C2O4)3]+ Na3[Co(NO2)6]
→ K2Na[Co(NO2)6]↓
(на ион К+)
желтый
осадок
)
K3[Fe(C2O4)3]+
Снимаем
спектр поглощения 0,01М раствора K3[Fe(C2O4)3] (l=10мм)
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
λ |
315 |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
|
D |
0,13 |
0,415 |
0,025 |
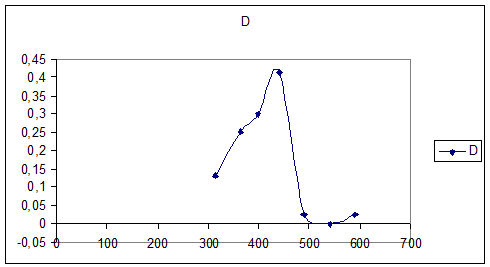
График №3
Спектра поглощения раствора K3[Fe(C2O4)3]
Заключение
В
результате проведения данной курсовой работы мы рассмотрели циклические
комплексы, изучили со стороны теории комплексных соединений, дав теоретическое обоснование
их химической и физических свойств; провели синтез представителей данного
класса веществ: триоксалатоферрат(III) калия K3[Fe(C2O4)3]
, диоксалатокупрат (II)калия K2[Cu(C2O4)2]·2H2O,
хлорид трисэтилендиамин кобальта III, подтвердили их качественный состав, сняли
спектры поглощения 0, 01 молярных растворв.
хелатный комплекс вещество химический
Список литературы
1. Васильев В.П. Аналитическая химия. Учеб. для студ.
вузов. 2-е изд., перераб и дополненное — М.: Дрофа, 2002. — 368с.: ил.
2. Желиговская Н.И., Черняев И.И., Химия комплексных
соединений. М.: Высшая школа, 1966. — 340с.
. Третьяков Ю.Д. Неорганическая химия, Т.2: Химия
непереходных элементов: Учебник для студ. высш. учеб. — М.: Издательский центр
«Академия», 2004. — 368с.
. Третьяков Ю.Д. Неорганическая химия, Т.2:
Физико-химические основы неорганической химии: Учебник для студ. высш. учеб. —
М.: Издательский центр «Академия», 2004. — 240с.
. Кнорре Д.Г. Физическая химия: Учебник для студ.
высш. учеб. — М.: Высшая школа 1990. — 416с.: ил.
. Угай Я.А. Общая и неорганическая химия: Учеб. для
вузов 3-е изд., испр. — М.: Высшая школа 2002. — 527с.: ил.
. Третьяков Ю.Д. Практикум по неорганической химии:
Учеб. пособие для студ. высш. уч. заведений. М.: Издательский центр «Академия»,
2004. -384с.:ил.
. Зломанов В.П. Практикум по неорганической химии:
Учеб. пособие. — М.: МГУ, 1994. — 320с.: ил.
Это важно
Согласно Директиве 2003/2003 хелатом можно назвать продукт, в котором 80 % микроэлементов хелатизированы. Самые лучшие удобрения – это те, где количество соединенных частиц метала и количество хелатизурующего вещества равно (полная хелатизация).
Когда в процессе производства удобрения применяется меньше хелатизирующего вещества чем частиц метала получается чaстичная хелатизация. Например, удобрение где 80 % микроэлементов хелатизировано а 20 % не хелатизировано. В момент применения такого удобрения в неблагоприятных условиях часть катионов метала, которые не были хелатизированы, может быстро перейти в форму, недоступную растениям. Поэтому стоит внимательно читать этикету продукта и проверять содержит ли оно микроэлементы со 100 % хелатизацией.
Александра Миллер, директор международного отделения «ADOB»
Биологические функции
Хелатирование — фундаментальное природное явление.
- В биоинорганической химии : например, ионы кобальта в витамине B 12 , магний в хлорофилле , медь в гемоцианине или железо в гемоглобине хелатированы.
- В биологии : большинство живых организмов вырабатывают особые белки ( металлотионеин ), богатые серой, которые помогают выводить токсины из организма. Кроме того, большинство растений выделяют хелаторы из своих корней, чтобы облегчить абсорбцию определенных элементов в почве.
- У людей люди делают это более или менее эффективно в зависимости от их генетической структуры . Те, чей организм не детоксифицируется достаточно быстро, больше подвержены риску развития нейродегенеративных заболеваний ( в частности, болезни Альцгеймера (БА)), особенно в случае воздействия неорганической ртути, теряемой из-за зубных пломб . У людей, генетически менее приспособленных к его детоксикации, ртуть количественно увеличивается, а ее токсические эффекты усиливаются ( гидраргия ). Примечание. Генетическая восприимчивость к ртути связана с полиморфизмом гена аполипопротеина E или APOE ; это коррелирует с гораздо более высоким риском развития болезни Альцгеймера и ее развития в более молодом возрасте. В последнем случае умеренное когнитивное нарушение также имеет большую прогностическую ценность. Этот ген APOE существует в 3 формах (аллели APOE2, APOE3 и APOE4). APOE2 скорее защищает, а APOE4 подвергает максимальному риску (в том числе для возраста). Например, европеоид, гомозиготный по APOE2, имеет в 25 раз меньший риск БА, чем его гомозиготный аналог по APOE4 (OR = 0,6 против 14,9).
Инструкция по применению
Хелатом железа можно удобрять, внося его под корни или опрыскивая им растения по листьям. Рассмотрим разные способы применения микроудобрения для огородных и комнатных растений.
Внекорневая обработка
5 г порошка растворить в 5 л воды. Для плодово-ягодных и овощей на 1 кв. м. расходуется 1 л раствора. Опрыскивание проводить для деревьев и кустарников 1-й раз во время распускания почек, 2-й – через 2 недели. Овощи опрыскивать 1-й раз при достижении ими стадии 3-4 листьев, 2-й раз – перед тем, как они начнут цвести.
Корневое внесение
Для полива используют раствор той же концентрации, но на 1 кв. м. расходуют по 2 л. Полив проводят в начальных стадиях роста растений, последующие поливы – через 2 недели.

Использование для комнатных растений
Цветы обычно выращиваются в условиях нехватки освещения, потому их потребность в железе несколько больше, чем у огородных растений. Необходимо вносить это удобрение и под те цветы, которые растут в кислом грунте, например, под орхидеи. Концентрация раствора – 1 г на 1 л, расход – до промокания кома земли.
Лечение хлороза
Хлороз – симптом серьезной нехватки железа. Лечить его нужно быстро, поэтому лучше воспользоваться внекорневым внесением удобрений. Железо из раствора на листьях начинает действовать уже через сутки после опрыскивания, тогда как после полива – через 3 дня. Концентрация для лечения хлороза – в 2 раза больше, чем при обычной подкормке. Количество подкормок хелатом – до исчезновения симптомов с интервалом в 2 недели.
Для каких культур применяется вика как сидерат, когда посеять и выращиваниеЧитать
Самостоятельное приготовление хелата железа
 Производители хелата железа обычно указывают на упаковке процентное содержание этого микроэлемента в растворе. Оно может колебаться от 6 до 13%. Но с точки зрения практического использования эта информация менее ценная, чем указание хелатирующего агента.
Производители хелата железа обычно указывают на упаковке процентное содержание этого микроэлемента в растворе. Оно может колебаться от 6 до 13%. Но с точки зрения практического использования эта информация менее ценная, чем указание хелатирующего агента.
Учитывая, что расход хелата железа и рабочего раствора довольно высок, а обработок для достижения эффекта потребуется не менее четырёх, этот препарат нельзя назвать дешёвым. К счастью, железо легко можно хелатировать в домашних условиях. Для этого сгодятся вещества, которые имеются в распоряжении любого дачника:
- аскорбиновая или лимонная кислота, яблочный уксус;
- железный купорос.
Указанные кислоты образуют с молекулами железа нестойкие соединения, поэтому готовить домашние хелаты нужно непосредственно перед использованием. Если их долго хранить, растворы стареют, меняют цвет, а железо выпадает в осадок.
У лимонной кислоты есть важное свойство, которое позволит не только подкормить растения железом. В биохимии существует такое понятие как цикл Кребса
Это основа метаболизма растительной клетки, благодаря которой осуществляется её снабжение энергией. Химические реакции, протекающие при этом, происходят при участии лимонной кислоты.
Чтобы сделать хелат железа, нужно взять порошок железного купороса и лимонную кислоту в пропорции 1:1,5 ⊕ Применение железного купороса на огороде. Например, для приготовления 1 литра хелатного раствора
 Самостоятельное хелатирование железа – процесс несложный, но приготовленные растворы быстро теряют свои свойства.
Самостоятельное хелатирование железа – процесс несложный, но приготовленные растворы быстро теряют свои свойства.
потребуется 4 г кислоты и 2,5 г купороса. Сначала в воде полностью растворяется кислота. Затем в раствор постепенно подмешивается купорос. В итоге получается жидкость лимонного цвета, которая содержит 0,5 г/л двухвалентного железа в форме цитрата.
Если для хелатирования берётся аскорбиновая кислота в таблетках, она должна быть чистой, без красителей и глюкозы. Таблетки предварительно перетираются в порошок. На полулитровую банку воды потребуется 10 г аскорбинки. После растворения кислоты в раствор вводится 1 чайная ложка железного купороса. Затем всё разбавляется водой – конечный объём жидкости должен быть равен 3 литрам.
ТОП лучших препаратов железа при низком гемоглобине
№1 – «Фенюльс» (капсулы)
- хронических кровопотерях;
- алиментарной недостаточности;
- повышенной потребности.
Фенюльс капсулы 30 шт.
Производитель: Ranbaxy , Индия
Феррум Лек таблетки жевательные 100 мг 30 шт.
Производитель: Lek d. d. , Словения
№3 – «Феррум Лек» (раствор)
Феррум Лек раствор для внутримышечного введения 50 мг/мл ампулы 2 мл 5 шт.
Производитель: Lek d. d. , Словения
№4 – «Сорбифер Дурулес» (таблетки)
Сорбифер Дурулес таблетки покрытые пленочной оболочкой флакон 50 шт.
Производитель: EGIS Pharmaceuticals , Венгрия
№5 – «Тотема» (раствор для приема внутрь)
- Железо. Синтезируем гемм, входящий в состав гемоглобина и принимающий участие в окислительно-восстановительных реакциях.
- Марганец и медь. Кофакторы (соединения, участвующие в биологической деятельности) ферментов.
Тотема раствор для приема внутрь 10 мл ампулы 20 шт.
Производитель: Innothera Chouzy , Франция
Мальтофер капли для приема внутрь 50 мг/мл флакон 30 мл
Производитель: Vifor , Швейцария
Мальтофер Фол таблетки жевательные 30 шт.
Производитель: Vifor , Швейцария

Мальтофер таблетки жевательные 100 мг 30 шт.
Производитель: Vifor , Швейцария
Мальтофер сироп 10 мг/мл флакон 150 мл
Производитель: Vifor , Швейцария
Ферлатум раствор приема внутрь 15 мл флакон 20 шт.
Производитель: Italfarmaco , Испания
№11 – «Ферлатум Фол» — порошок для приготовления раствора
- при латентном и клинически выраженном дефиците;
- для профилактики в период беременности, лактации, при длительных кровотечениях, в период активного роста и при несбалансированном или неполноценном питании.
Ферлатум Фол раствор для приема внутрь 15 мл флакон 10 шт.
Производитель: Italfarmaco , Италия
№12 – «Ферретаб» (капсулы)
- Железа фумарат. Принимает участие в синтезе гемоглобина. Представлен в виде солей, которые быстро восполняют дефицит микроэлементов в организме, постепенно устраняя повышенную утомляемость, слабость, тахикардию и головокружение. Также исчезает сухость и бледность кожи.
- Фолиевая кислота. Способствует нормальному созреванию мегалобластов и образованию нормобластов. Принимает участие в синтезе аминокислот. Предупреждает развитие анемии, выкидыши и преждевременные роды. Исключает нарушение умственного развития у детей.

Ферретаб комп. капсулы пролонгированного действия 30 шт.
Производитель: Lannacher Heilmittel , Австрия
Фероглобин В-12 капсулы 30 шт.
Производитель: Vitabiotics , Великобритания
№14 – «Актиферрин» (капли для приема внутрь)

Актиферрин капли для приема внутрь флакон 30 мл
Производитель: Merckle , Германия
Выводыhttps://health.mail.ru/disease/anemiya/https://www.eurolab.ua/medicine/atc/list/82/https://www.vidal.ru/drugs/atc/b03ab
Когда необходимы?
Хелаты применяют для растений разных видов – плодовых, ягодных, овощных. Также этими удобрениями допустимо подкармливать декоративные культуры.
Чтобы удобрения дали нужный эффект, их требуется вносить на определенных этапах роста культур. Такими средствами можно обрабатывать следующее:
- Семена перед посадкой. Их можно замачивать в растворе удобрения, сочетая эту процедуру с протравливанием.
- Рассаду и саженцы. Благодаря поливу хелатными веществами удается улучшить приживаемость и развитие культур на новом месте, ускорить их адаптацию, повысить сопротивляемость инфекциям.
- Культуры перед началом цветения. Это помогает увеличить количество завязи.
- Растения во время роста плодов. Хелаты помогают повысить параметры урожайности и сделать плоды более качественными.
Хелаты допустимо комбинировать с пестицидами или использовать их растворы после химической обработки. Это значительно ускорит восстановление культур.

Можно ли микроэлементы заменить другими веществами?
Классические способы удобрения не могут восполнить должный объем микро- и макроэлементов утраченных почвой необходимых для активного и полноценного развития растения. К примеру, такое распространенное заболевание как хлороз (пожелтение листьев) можно устранить восполнив уровень железа. Поэтому рационально выполнять подкормки микроудобрениями. Для достижения более высоких качественных и количественных показателей роста и урожая растений рекомендуется совместное использование органоминеральных и минеральных удобрений. Поэтому применение препарата «Интермаг Огород» с Гумат калия «Суфлер» позволит обеспечить макисмальный эффект урожая.
Лучшие хелатные препараты
Для себя я выбрала производитель KAL, Таурат магния+, 400 мг, 90 таблеток

Не вызывает поноса, вздутие живота, широко применяется, как добавка с заболеванием сердечно-сосудистой системы.
Доза одной таблетки 200 мг Mg, содержание витамин В6 с ферментом пиридоксаль-5-фосфат для лёгкого всасывания. С добавками повышающий эффект компонентов: экстракт имбиря, чёрный перец (биоперин), кайенский перец, розмарин, куркума. Приемлемая цена — на 1,5 месяца по 2 таблетки в день.
Тем, кто против добавок в виде экстрактов, перца и трав, рассмотрим ещё один интересный вариант суспензий. KAL, Глицинат магния 400, без сои, 400 мг, 60 мягких капсул.

Он чуть дороже, но имеет своих поклонников, правда, в нём нет витамина В6, но его можно принимать отдельно.
Есть мнение, что в гелиевой форме усвоение лучше, так как уже нетвёрдая консистенция. Содержит карбонат кальция, но в очень маленьком количестве не влияющий на костную структуру. Зато, нет никаких дополнительных примесей на которые, может быть, аллергия. Добавка выпускается количеством 60, но есть и таблетированная — по 90 и 180 штук, разница только в цене (дешевле).
Хочется отметить Треонат Mg Now Foods, Magtein, магния L-треонат, 90.

Новейшая форма разработки китайских учёных, где Mg, с помощью L-threonate, способен беспрепятственно проникать в нейрон, это клетка, отвечающая за память, внимание, концентрацию и т. д., через защищённое соединение гематоэнцефалический барьер и передавать импульсы информации по синапсам другим клеткам
Тем самым LT-молекула кислоты, помогает элементу накапливаться в мозге, улучшая высшие мозговые способности (когнитивные функции). Рекомендуется пожилым и больным Альцгеймера, но принимают биодобавку и более молодое поколение для профилактики мозговой деятельности в основном. Этот препарат относится к категории «Цена — качество», чем себя и оправдывает.
Споры разгораются
Ещё в 40-е годы врачи начали давать ЭДТА рабочим оружейных заводов при отравлениях свинцом, но неожиданно обнаружили, что после хелатотерапии у страдающих атеросклерозом (заболевание, при котором сосуды и артерии забиваются образованиями в виде бляшек, что может привести к сердечным приступам) улучшилось кровообращение, дыхание и т. д., что, как предполагалось, было вызвано разблокировкой артерий.
В последние 30 лет в околомедицинских кругах разгорелись жестокие споры по поводу того, можно ли хелатотерапией с помощью ЭДТА лечить атеросклероз. Никто не спорит, что препарат эффективен для лечения отравлений дигиталисом, гиперкальциемии (повышенное содержание кальция в крови) и некоторых видов отравлений тяжёлыми металлами. В 1991 году было утверждено новое вещество для проведения пероральной (то есть принимаемой через рот) хелатотерапии при тяжёлых отравлениях свинцом. Но большая часть сторонников этого метода настаивают на том, что он неэффективен для лечения людей с заболеваниями сердца.
Врачи же, использующие ЭДТА при лечении атеросклероза, утверждают, что содержание кальция в клетках кровеносных сосудов и артерий уменьшается и затем он удаляется из них (хотя и не путём «захватывания», как в случае со свинцом или железом) там, где скапливаются жировые отложения и другие минеральные вещества.
Одним из результатов такого лечения является уменьшение бляшек и улучшение кровообращения в артериях ног и коронарных сосудах, снабжающих сердце кровью. Врачи обнаружили значительное улучшение сердечной деятельности у 77% от общего числа пациентов. В случае с пациентами, у которых сердечные нарушения вызваны различными заболеваниями сосудов, результаты оказались ещё лучше: после хелатотерапии улучшение отмечалось у 91% пациентов.
Это исследование подтверждает мнение, что внутривенная хелатотерапия с использованием ЭДТА безопасна и эффективна при лечении людей, страдающих хроническими дегенеративными заболеваниями, особенно сердечно-сосудистыми нарушениями, связанными с атеросклерозом.
Применения хелата железа для растений
Использование хелата железа сильно отличается в зависимости от ожидаемого эффекта и причины использования. На основании того, используется препарат для профилактики или восстановления растения, может отличаться дозировка, интервал внесения удобрения и период применения.
Для розничных покупателей в магазине продаётся удобрение в небольших упаковках или средство может быть приготовлено самостоятельно
Профилактика
Следует разводить препарат в концентрации 5 г на ведро воды. После получения однородного раствора проводят опрыскивания зелёной части растения. Рекомендуется проводить обработку от 2 раз. Впервые использовать препарат можно после выброса первого листочка, а продолжать процедуру стоит на протяжении всего вегетационного периода. Предпочтительно выдерживать интервал в 2 недели между опрыскиваниями.
В последний раз проводить обработку нужно ещё до расцветания растения. Расход препарата составляет 1 л на 10 м2.
Микроудобрение Хелат Железа
Лечение хлороза
Для терапии болезни растений стоит вдвое увеличить дозировку до 5 г на 5 л воды – концентрация действует в отношении всех плодовых деревьев. Все остальные культуры требуют использование раствора 5 г на 8 л воды. После приготовления смеси стоит обильно опрыскать всю зелень деревьев или растений.
Количество обработок 2 в месяц с равномерными интервалами. Для достижения позитивного результата стоит выполнять процедуру от 4 раз.
Для усиления лечебных свойств препарата, требующихся при запущенной форме хлороза, можно проводить корневую подкормку. Для выполнения подливания стоит делать раствор 5 г на 5 л воды и покрывать веществом землю, на 1 м2 используют 2 л жидкости.
Препарат является относительно безопасных и практически неспособен нанести ущерб человеку, но перед использованием стоит позаботиться о базовых правилах личной безопасности:
перед проведением обработки используют резиновые перчатки;
после проведения опрыскивания или подливания обязательно надевать сменную одежду;
на голову следует надевать защитный убор, подойдёт платок, кепка и т
п.;
обязательно защитить органы зрения и дыхания, надевая повязку из марли и защитные очки – это важно при распылении вещества;
после окончания процедуры нужно вымыть руки, лицо и открытые участки кожи с помощью мыльного раствора под проточной водой;
в случае попадания вещества на слизистые оболочки следует сразу провести промывание обычной водой из крана.
Лечение хлороза при помощи Хелата железа
Проблема недостатка питательных элементов
Микроэлементы (железо, марганец, цинк, медь) как и макроэлементы необходимы растениям. Хотя микроэлементов требуется растениям значительно меньше в количественном выражении, это не меняет того факта, что отдельные микроэлементы невозможно заменить.
Стандартные анализы почвы дают нам информацию о содержании P, K, Mg а также рН. Оптимально было бы иметь полную информацию о содержании остальных макро- и микроэлементов. Но такие анализы делают только в некоторых лабораториях.
Микроэлементы усваиваются из почвы только совместно с водой. Поэтому, когда влажность почвы невысокая усвоение затруднено. В этом случае микроэлементы, содержащиеся в почве, (металлы Fe, Mn, Zn, Cu, а также B и Mo) могут переходить в химические формы, недоступные растениям. Причиной этого явления также являются физико-химические свойства почвы, ее структура, рН, содержание углекислорода кальция или соединений фосфора.
Небольшой недостаток какого-либо микроэлемента сначала может иметь у растений скрытую форму, при которой нет никаких внешних признаков этой нехватки. Но когда недостаток (например, Fe, Mn, Zn, Cu B и Mo) высокий, тогда симптомы этого заметны на растениях.
При недостатке микроэлементов необходимо провести некорневую подкормку посевов. Иначе состояние растений ухудшится (слабый рост, плохая устойчивость против болезней и вредителей), а в итоге – получится невысокий урожай плохого качества.
Примечания и ссылки
- (in) Роджер Сегелкен , на Cornell Chronicle ,22 февраля 1999 г.(по состоянию на 17 июля 2021 г. )
- Саймон Сингх и Эдзард Эрнст ( перевод с английского Марселя Бланка), Альтернативная медицина: информация или интокс? , Париж, Кассини,2014 г., 416 с. ( ISBN 978-2-84225-208-3 , OCLC )
- Д. Ф. Шрайвер и П. У. Аткинс ( перевод с английского Андре Пусса), Chimie inorganique , Париж, Университет Де Бока,2001 г., 763 с. , часть 1, гл. 7 («Комплексы d- металлов »), с. 243
- Жан-Франсуа Моро-Годри, « Минеральное питание растений: молекулярный аспект », Французская сельскохозяйственная академия ,2013
- Муттер Дж., Науман Дж., Садагиани С., Шнайдер Р., Валах Х. Болезнь Альцгеймера: ртуть как патогенетический фактор и аполипопротеин Е как модератор ; Neuro Endocrinol Lett., Октябрь 2004; 25 (5): 331-9.
- Blacker D, Haines JL, Rodes L, Terwedow H, Go RC, Harrell LE, Perry RT, Bassett SS, Chase G, Meyers D., Albert MS, Tanzi R. ApoE-4 и возраст начала болезни Альцгеймера: NIMH генетическая инициатива . 1: Неврология. Январь 1997 Янв; 48 (1): 139-47
- Olarte L, Schupf N, Lee JH, Tang MX, Santana V, Williamson J, Maramreddy P, Tycko B, Mayeux R. Аполипопротеин E epsilon4 и возраст начала спорадической и семейной болезни Альцгеймера у выходцев из Карибского бассейна . ; Arch Neurol. Ноябрь 2006 г .; 63 (11): 1586-90
- Aggarwal NT, Wilson RS, Beck TL, Bienias JL , Berry-Kravis E, Bennett DA. ; Аллель аполипопротеина E epsilon4 и болезнь Альцгеймера у лиц с легкими когнитивными нарушениями. Нейроказ. Февраль 2005 г .; 11 (1): 3-7
- Хуан Ю .; Аполипопротеин Е и болезнь Альцгеймера. ; Неврология. 24 января 2006 г .; 66 (2 доп. 1): S79-85
- Slooter AJ, Cruts M, Kalmijn S, Hofman A, Breteler MM, Van Broeckhoven C, van Duijn CM Arch Neurol; Оценка риска деменции по генотипам аполипопротеина E из популяционного исследования заболеваемости: Роттердамское исследование. Июль 1998 г .; 55 (7): 964-8
- Влияние возраста, пола и этнической принадлежности на связь между генотипом аполипопротеина E и болезнью Альцгеймера. Метаанализ. Консорциум метаанализа APOE и болезни Альцгеймера. Фаррер Л.А., Капплс Л.А., Хейнс Дж.Л., Хайман Б., Кукулл В.А., Майе Р., Майерс Р.Х., Перикак-Ванс М.А., Риш Н., ван Дуйн С.М. ЯМА. Октябрь 1997 г .; 2-29; 278 (16): 1349-56.
- Джаясумана С., Гунатилаке С., Сенанаяке П. (2014). Глифосат, жесткая вода и нефротоксические металлы: виноваты ли они в эпидемии хронической болезни почек неизвестной этиологии в Шри-Ланке? Int J Environ Res Public Health; 11: 2125–47. DOI: 10.3390 / ijerph110202125
- ↑ и
- ↑ и (in) Арла Дж. Бакстер и Эдвард П. Крензелок, « Педиатрическая летальность, вызванная хелатированием ЭДТА , Clinical Toxicology , Vol. 6,2008 г., стр. 1083–1084 ( ISSN , DOI ).
- (in) Стивен М. Шор и Линда Г. Растелли ( перевод Йозеф Шованек и Кэролайн Глорион ) « Понимание аутизма для чайников , первые издания»,март 2015, 384 с. ( ISBN 2-7540-6581-4 ).
- (в) Бернард Metz , Джеймс А. Mulick и Эрик М. Butter , «Аутизм: Поздний 20-го века Причуда Магнит» в Спорные Терапии для порокам развития: Fad, мода, и науки в профессиональной практике , CRC Press,2005 г., 528 с. ( ISBN и ) , стр. 248–249.
- (in) Калпана Патель и Люк Т. Кертис , « Комплексный подход к лечению аутизма и синдрома дефицита внимания с гиперактивностью: предварительное исследование » , Журнал альтернативной и дополнительной медицины (Нью-Йорк, Нью-Йорк) , том. 13,1 — го декабря 2007, стр. 1091–1097 .
- , стр. 249.
- , стр. 145-149.